شناخت و استفاده از جدول تناوبی عناصر از موارد مهمی است که برای کسانی که به دروس رشته شیمی علاقه دارند و میخواهند این رشته را فرا بگیرند ضروری است. مهمترین قدم در شناخت کلی گروههای جدول تناوبی شناخت خواص عناصر جدول تناوبی است. اگر گروهها و ویژگیهای جدول تناوبی را به خوبی بشناسیم میتوانیم عناصر مختلف را در این گروهها بررسی کنیم.

گروه های مختلف جدول تناوبی کدام ها هستند؟
در اواخر قرن نوزدهم یک شیمیدان روسی به نام دمیتری مندلیف برای اولین بار تلاشهای خود را برای گروهبندی عناصر شیمیایی مختلف براساس جرم اتمی در یک مقاله به چاپ رساند. در زمان مندلیف تنها 60 عنصر شناخته شده وجود داشت، اما این شیمیدان با مرتب کردن عناصر براساس جرم متوجه شد که عناصر را میتوان در دورههای منظم در کنار یکدیگر قرار داد و به یک جدول تناوبی برای عناصر دست یافت.
برای شناخت عناصر رادیواکتیو کلیک کنید.
جدول تناوبی عناصر دارای 18 گروه است که اتمهای هر یک از این گروهها دارای تعداد برابری الکترون لایه ظرفیت هستند. اسامی گروههای مختلف جدول تناوبی را در ادامه آوردهایم.
- گروه اول (فلزات قلیایی)
- گروه دوم (فلزات قلیایی خاکی)
- گروه سوم تا 15 ام (فلزات واسطه)
- گروه 13ام (گروه خانواده بور)
- گروه 14ام (گروه خانواده کربن)
- گروه 15ام (گروه خانواده نیتروژن)
- گروه 16ام (گروه خانواده اکسیژن)
- گروه 17ام (گروه هالوژن ها)
- گروه 18 ام (گروه فلزات نجیب)
پس از گذشت 150 سال از زمان مندلیف امروزه 118 عنصر دیگر کشف شده است که به جدول مندلیف اضافه شده است. همچنین تا سال 2016، 4 عنصر دیگر نیز کشف شده است که در همان جدول تناوبی از سادهترین اتم یعنی هیدروژن آغاز میشود و به سایر عناصر جدول تناوبی که براساس عدد اتمی مرتب شدهاند ادامه پیدا میکند.

گروه های جدول تناوبی به چه صورت است؟
در هر گروه از جدول تناوبی که شامل یک ستون از جدول تناوبی است و عناصر در هر گروه از جدول تناوبی قرار دارند خواص مشابهی را میتوان مشاهده کرد. جدول تناوبی عناصر از 8 گروه اصلی تشکیل شده است و با نامهای گروههای 1 ،2 و 13 تا 18 شناخته میشوند.
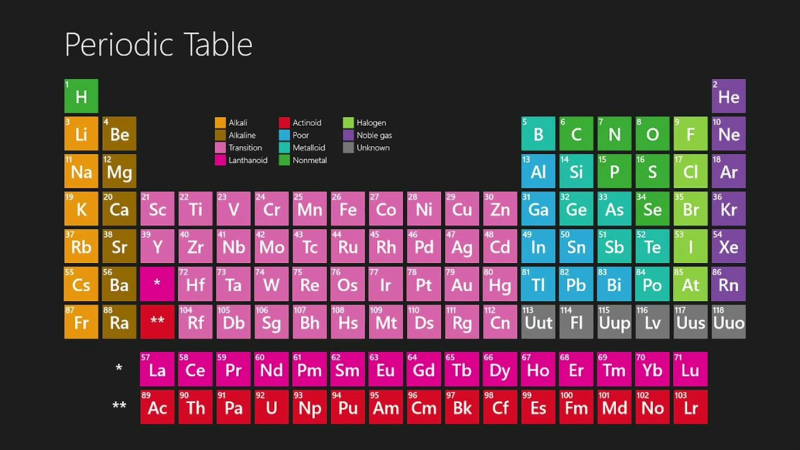
گروه های جدول تناوبی
گروه اول جدول تناوبی
فلزات قلیایی یا گروه اول جدول تناوبی که با نام خانواده لیتیوم نیز شناخته میشوند، تمامی عناصر ستون اول جدول تناوبی بجز هیدروژن را شامل میشوند. این عناصر براق هستند و بدلیل نرم بودن به راحتی با چاقو برش داده میشوند. اولین گروه جدول تناوبی از عنصر لیتیوم شروع میشود و به عنصر فرانسیم ختم میشود. عناصر گروه اول جدول تناوبی به شدت واکنشپذیر هستند و در تماس با آب به صورت انفجاری واکنش میدهند و تولید شعله میکنند. بدلیل واکنشپذیری بالای این عناصر شیمیدانها این عناصر را در داخل نفت، روغن و یا گازهای بی اثر نگهداری میکنند. آرایش الکترونی لایه آخر عناصر این گروه به صورت ns1 است.

گروه دوم جدول تناوبی
گروه دوم جدول تناوبی با نام فلزات قلیایی خاکی در جدول تناوبی قرار دارند. این گروه با نام خانواده برلیم نیز شناخته میشوند. این گروه از جدول تناوبی با برلیم شروع میشود و به عنصر رادیم ختم میشود. در این گروه از عناصر جدول تناوبی در خارجیترین لایه تنها 2 الکترون وجود دارد و به همین دلیل این عناصر واکنشپذیری بالایی دارند و به ندرت به صورت خالص در طبیعت یافت میشوند. واکنش شیمیایی عناصر گروه دوم به آهستگی انجام میشود و گرمای کمتری به نسبت فلزات قلیایی تولید میکنند. آرایش الکترونی لایه ظرفیت این گروه به شکل ns2 است.

گروه فلزات واسطه جدول تناوبی
به گروههای 3 تا 12 جدول تناوبی گروه فلزات واسطه یا عناصر واسطه گفته میشود. این عناصر در زیرلایه d به صورت جزئی پر شده هستند. لانتانیدها و اکتینیدها نیز جزء گروه فلزات واسطه قرار میگیرند. عناصر واسطه فلزاتی سخت، چکشخوار، براق و رسانای خوب الکتریسیته هستند. شکل و خواص فلزات واسطه شبیه به طلا، نقره، آهن، مس و پلاتین است که میتواند به شما کمک کند تا ظاهر فلزات واسطه را بهتر بشناسید.
مطالب مرتبط: جیوه قرمز چیست و چه کاربردی دارد؟
لانتانیدها و اکتینیدها
لانتانیدها که گروه سوم هستند بسیار طولانی هستند بنابراین نمیتوان آنها را به طور کامل در ستون سوم جای داد. به همین دلیل این گروه را با نام لانتانیدها از جدول خارج میکنند و به صورت یک سطر در پایین جدول قرار دادهاند. عناصر 57 تا 71 در دسته لانتانیدها هستند و به رنگها سفید-نقرهای وجود دارند که در تماس با هوا تیره رنگ میشوند. اکتینیدها نیز مانند لانتانیدها در خارج از جدول قرار گرفتهاند و عناصر 89 تا 103 را تشکیل میدهند. توریم و اورانیم تنها عناصری هستند که به مقدار قابل توجهی در طبیعت یافت میشوند و جزء عناصر رادیواکتیو هستند. لانتانیدها و اکتینیدها به فلزات واسطه داخلی شهرت دارند.

ساختار جدول تناوبی به چه شکلی نوشته شده است؟
جدول تناوبی دارای 7 سطر و 18 ستون است که به شکل زیر ساختار یافتهاند.
سطرهای جدول تناوبی
هر سطر در جدول تناوبی نشان دهنده یک دوره یا تناوب است. عدد تناوبی یک عنصر مشخص میکند که چه تعداد از سطوح انرژی هر عنصر دارای الکترون است. به طور مثال اتم سدیم در تناوب سوم قرار گرفته است و به معنای این است که این اتم به طور معمول در سه سطح اول انرژی خود دارای الکترون است. با حرکت کردن از سمت بالا به پایین طول دورهها بیشتر میشود زیرا لایههای الکترونی با ظرفیت بیشتری برای اشغال شدن توسط الکترون در دسترس اتمها قرار میگیرد.

ستون های جدول تناوبی
ستونهای جدول تناوبی نشان دهنده گروهها یا عناصر هم خانواده با یکدیگر هستند. عناصری که در گروههای جدول تناوبی قرار دارند به طور معمول رفتار مشابهی دارند زیرا تعداد الکترونهای یکسانی در خارجیترین لایه خود را شامل میشوند. به طور مثال در گروه 18 در سمت راست جدول لایههای خارجی پر شده و کاملی از الکترون وجود دارد که باعث واکنشپذیری کم آنها در واکنشهای شیمیایی شده است.

شیوه طبقه بندی عناصر چگونه است؟
عنصرها در جدول تناوبی به طور معمول در 2 دسته فلز و نافلز تقسیمبندی میشوند، اما نمیتوان به طور معمول مرز دقیقی بین عناصر جدول تناوبی مشخص کرد. عنصرهای فلزی به طور معمول هادی خوب جریان الکتریسیته و حرارت هستند. زیرگروههای دیگر فلزی نیز بر اساس خواص مشترک شیمیایی بنا شدهاند و به همین دلیل در قالب گروههای جدول تناوبی بررسی میشوند.
طبقهبندی عناصر در جدول تناوبی به شکل دیگری است که در ادامه آن را توضیح میدهیم.
در جدول تناوبی عناصر به دستهبندیهای فلزات پس واسطه، شبه فلزات و نافلزات دستهبندی میشوند. فلزات پسواسطه شامل آلومینیوم، گالیم، ایندیم، تالیم، قلع، سرب و بیسموت هستند که در میان گروههای 13 تا 17 پراکنده شدهاند. این فلزات دارای خواصی همچون فلزات واسطه هستند، اما نرمتر هستند و دارای رسانایی بیشتری هستند.
بور، سیلیسم، ژرمانیم، آرسنیک، آنتیموان، تلوریم و پولونیوم از عناصر شبه فلزات هستند. عناصر شبه فلزات در برخی موارد همچون عناصر نیمه هادی رفتار میکنند و از جمله آنها باید به عناصر بور، سیلیسیم و ژرمانیم اشاره کرد.
نافلزات در جدول تناوبی به طور کلی شامل 17 عنصر میشوند که بیشتر شامل گازهای هیدروژن، هلیم، نیتروژن، اکسیژن، فلوئور، نئون، کلر، آرگون، کریپتون، زنون و رادون میشوند. برم و برخی جامدات همچون کربن، فسفر، گوگرد، سلنیم و ید از نافلزات شناخته شده هستند که در این دسته قرار میگیرند.

تعداد الکترون های لایه ظرفیت در جدول تناوبی
الکترونهایی که در بیرونیترین لایه الکترونی عناصر وجود دارند به طور معمول با نام الکترونهای لایه ظرفیت یا الکترونهای لایه والانس شناخته میشوند. در جدول زیر تعداد الکترونهای لایه ظرفیت را آوردهایم، اما باید توجه داشته باشید که روش کلی برای شمارش الکترونهای لایه ظرفیت به طور معمول برای فلزات واسطه کاربرد ندارد. همچنین هلیم عنصری است که در گروه 18 جدول تناوبی قرار دارند، اما شامل 2 الکترون است.
| گروه های جدول تناوبی | الکترونهای ظرفیت |
|---|---|
| گروه ۱ (فلزات قلیایی) | ۱ |
| گروه ۲ (فلزات قلیایی خاکی) | ۲ |
| گروه ۳ - ۱۲ (فلزات واسطه) | ۲ |
| گروه ۱۳ | ۳ |
| گروه ۱۴ | ۴ |
| گروه ۱۵ | ۵ |
| گروه ۱۶ | ۶ |
| گروه ۱۷ | ۷ |
| گروه ۱۸ | ۸ |
جدول تناوبی به شکل دایره ای چگونه است؟
برخی دانشمندان معتقدند که قرار دادن عناصر در یک دایره پیشنهاد صحیحتری است زیریا در این نوع از چینش عناصر میتوان به درک بهتری از اندازه نسبی اتمها دست یافت، به طوری که هر قدر اتمها به مرکز دایره نزدیکتر باشند، اندازه کوچکتر یا به عبارتی شعاع کمتری دارند. همچنین با قرار گرفتن اتمهای هلیم و هیدروژن در مرکز مشکل قرار دادن این عناصر در جدول تناوبی اصلی برطرف خواهد شد.

نتیجه گیری
جدول تناوبی عناصر اولین بار توسط مندلیف تدوین شد و در ادامه عنصرهای دیگری پس از کشف به این جدول اضافه شد.




ثبت ديدگاه