مولاریته که به آن غلظت مولی یا غلظت مولار نیز میگویند نوعی از غلظت است که در علم شیمی برای اندازهگیری غلظت محلولها استفاده میشود. در مقالات قبلی رایمون لب به موضوع درصد خلوص در مواد آزمایشگاهی پرداخته شد. در موضوع درصد خلوص تنها برای یک ماده مطرح است که نیاز به اندازهگیری میزان خالص بودن آن وجود دارد. در حالی که در طبیعت و محیط اطراف ما و آزمایشگاههای شیمی با مخلوطی از مواد و عناصر طبیعی سر و کار داریم. ترکیب نسبی مخلوطها نقش مهمی در تعیین خواص مواد بازی میکنند. بدلیل لزوم بررسی غلظت مواد در این محلولها موضوع اندازهگیری غلظت هر کدام از مواد در محلول مورد نظر اهمیت پیدا میکند. از غلظتهای مهم در محلولها غلظت مولاریته است که برای حل مسائل غلظت و دیگر موارد اهمیت پیدا میکند. اگر مقدار نسبی اکسیژن موجود در هوا را بخواهیم اندازه بگیریم، یا بخواهیم میزان وجود داشتن مقادیر نسبی آهن، کربن، نیکل و سایر عناصر موجود را در فولاد برای بررسی مقدار استحکام فیزیکی و مقاومت آن در برابر خوردگی را در نظر بگیریم، موضوع غلظت مولاریته و اندازهگیری میزان غلظت مواد اهمیت پیدا میکند. برای یادگیری موضوع غلظت مولاریته ابتدا باید با موضوع محلولها آشنا شوید و در مورد آن یاد بگیرید.
مولاریته چیست
محلول چیست؟
محلولها، مخلوطهایی همگن هستند که خواص آن در تمام حجم ماده یکسان است. محلولها را هم میتوان به صورت مصنوعی تعیین کرد و هم به طور طبیعی در طبیعت یافت میشوند.
غلظت محلول ها چیست؟
غلظت محلول به مقادیر نسبی از اجزای تشکیلدهنده یک مخلوط میگویند که آن را با نام غلظت میشناسند. در برخی موارد محلول شامل جزئی از مخلوط است که غلظت آن بیشتر از سایر اجزای مخلوط است. این جزء بیشتر را حلال میگویند. حلال محیطی است که سایر اجزا در آن پراکنده یا حل میشوند. محلولهای بسیاری در کره زمین وجود دارند که حلال آنها آب است؛ به این محلولها محلول آبی میگویند. به مادهای که در یک محلول وجود دارد و مقدار آن کمتر از حلال باشد، حلشونده میگویند. برای یادگیری تبدیل مولاریته به ppm کلیک کنید.
غلظت حلشونده را به طور معمول با عبارتهای رقیق (غلظت پایین) و غلیظ (غلظت بالا) توصیف میکنند.

مولاریته چیست
غلظت مولاریته در محلول ها چیست؟
غلظت مولاریته از واحدهای اندازهگیری غلظت است که بسیار پرکاربرد است. مولاریته از واحدهای پرکاربرد در غلظت مواد شیمیایی است که به صورت نسبت تعداد مولهای یک حلشونده به یک لیتر محلول تعریف میشود. رابطه اندازهگیری غلظت مولاریته به صورت زیر است:
M= مول حل شونده/ لیتر محلول

مولاریته چیست
مثال برای اندازه گیری محاسبه مولاریته محلول
مقدار 335 میلی لیتر از محلولی حاوی 0.133 مول ساکاروز است. غلظت مولی ساکاروز در محلول چقدر است؟
بدلیل آنکه مقادیر مولی حلشونده و مقدار حجم محلول را داریم، برای محاسبه مولاریته از فرمول آن استفاده میکنیم. برای این فرمول باید حجم محلول را از میلی لیتر به لیتر تبدیل کنیم.
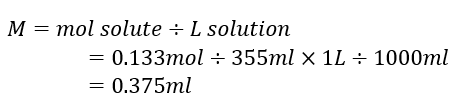
مولاریته چیست
مثال برای محاسبه مول و حجم به کمک مولاریته
مقدار شکر موجود در 10 میلی لیتر از محلول مثال قبل را اندازه گیری کنید.
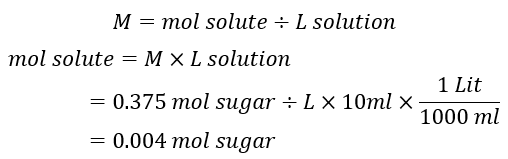
مولاریته چیست
شیوه محاسبه مولاریته با کمک جرم حل شونده
سرکه سفید تقطیر شده محلولی از استیک اسید است که با فرمول CH3COOH در آب است. نیم لیتر محلول سرکه حاوی 25.2 گرم استیک اسید است. غلظت این محلول استیک اسید را برحسب مولاریته محاسبه کنید.
مانند مثال قبل از مولاریته برای محاسبه مقدار مطلوب استفاده میکنیم. به جای مقادیر مولی حلشونده جرم آن را داده است. به همین دلیل باید جرم مولی حل شونده را بدست بیاوریم تا مقدار مول آن محاسبه شود:

مولاریته چیست
نکته مهم برای محاسبات مولاریته
برای انجام محاسبات در تعیین غلظت مولاریته مانند مثالهای قبل مرحله به مرحله پیش بروید و در هر مرحله محاسباتتان را بنویسید. دقت کنید که اعدادتان را گرد نکنید زیرا گرد کردن جوابها ممکن است باعث ایجاد خطا در جواب نهایی موردنظرتان شود. به عنوان مثال اگر تعداد مولهای NaCL را در مثال قبل به جای 1.325 مول به صورت گرد شده 1.32 مول در نظر میگرفتیم در ادامه محاسبات به عدد 77.1 گرم میرسیدیم که حدودا 0.3 گرم با عدد بدست آمده تفاوت داشت. همچنین در صورتیکه محاسبات را در یک مرحله انجام دهیم امکان وجود داشتن خطا کاهش پیدا میکند و گرد کردن اعداد تنها در مرحله آخر وجود خواهد داشت.

مولاریته چیست
مثال برای تعیین حجم محلول
در دو مثال قبل دیدیم که غلظت سرکه برابر با 0.839M بود. چه حجمی از سرکه دارای 75.6 گرم استیک اسید است؟
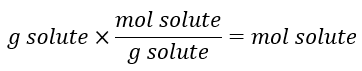
مولاریته چیست
سپس از مولاریته محلول برای محاسبه حجم محلول استفاده میکنیم.
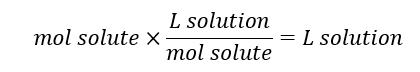
مولاریته چیست
با ترکیب کردن این دو ترکیب در رابطه به فرمول زیر میرسیم:
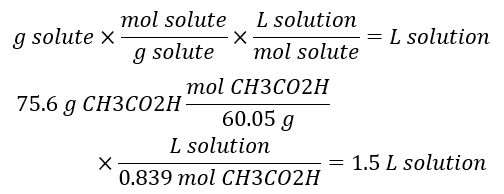
مولاریته چیست
رقیق سازی محلول چگونه است؟
رقیق سازی یا رقیق کردن به فرآیندی میگویند که در طی آن غلظت یک محلول با اضافه کردن حلال به آن کم میشود. به طور مثال زمانی که یک قطعه یخ را داخل شربت میاندازیم با آب شدن یخ غلظت شربت کاهش پیدا میکند. آب ذوب شده از قالب یخ را داخل شربت میاندازیم، با آب شدن یخ، غلظت شربت کم میشود. آب ذوب شده از قالب یخ به آرامی حجم حلال (آب) و حجم کلی محلول را افزایش میدهد. با کاهش غلظت شربت طعم آن تغییر میکند و شیرینی آن کمتر میشود. رقیق سازی همچنین یک روش برای تهیه محلولهایی با غلظت مناسب به شمار میآید. در واقع محلولهای تجاری در غلظتی خاص به فروش میرسند، اما این غلظتها به طور معمول شامل غلظتهایی نیست که بتوان از آنها برای انجام آزمایشهای شیمیایی استفاده کرد. به همین دلیل باید برای انجام آزمایشات آنها را رقیق کرد. به عنوان مثال آفتکشها را میتوان در حجمهای کم و بسیار غلیظ به فروش رساند و برای استفاده از آنها نیاز هست تا این مواد را رقیق کرد تا به غلظت مورد نیاز ما در آزمایشگاه برسند. همچنین برای تهیه ریجنتهای آزمایشگاهی میتوان از این روش استفاده کرد.

مولاریته چیست
نتیجه گیری
در این مقاله درباره مولاریته صحبت کردیم و فهمیدیم که محلولها، مخلوطهایی همگن هستند که در آنها مواد حلشونده با مقادیر کم در حلال، حل شدهاند. همچنین در تعریف محلول آبی گفتیم که محلول آبی حلالی است که حلال آن آب باشد.




ثبت ديدگاه